Amyloid-Fibrillen und deren Auswirkungen
Neben dem nativen Zustand kann sich noch eine weitere thermodynamisch stabile Konformation, die sogenannte Amyloid-Fibrille, bilden. Diese Fibrillen bestehen aus den Aggregaten vieler Ketten. Überraschenderweise haben Fibrillen von verschiedenen Polypeptiden eine sehr ähnliche Morphologie, sind also unabhängig von der gegebenen Aminosäuresequenz. Daher kann ein Protein in einer stabilen Form mit spezifischer biologischer Funktion, sowie eine stabile toxische Form vorkommen. Dies schein somit eine allgemeine Eigenschaft von Polypeptidketten zu sein. Unterschiede zeigen sich in der Sekundär- und Tertiärstruktur der Moleküle und der gegenseitigen Wechselwirkung zwischen den verschiedenen Gruppen von Aminosäuren.
Ein typisches Beispiel für fibrillenformende Peptide sind Amyloid-β Peptide, die aus 36-43 Aminosäuren bestehen (siehe Abbildung 1). Die Pfeile markieren die β-Stränge, welche in Richtung einer Aminosäure mit einer freien Carboxylgruppe (COOH), dem C -Terminus im Polypeptid, zeigen.
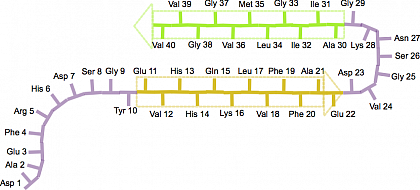
Abbildung 1: Schematische Darstellung der Struktur des Rückrats ("β-Haarnadel") eines Amyloid-β(1-40) Peptids in einer reifen Fibrille. Die entsprechenden β-Stränge reichen von Glu-11 bis Glu-22 (gelber Pfeil) und von Ala-30 bis Val-40 (grüner Pfeil), nach Scheidt, H. A., Morgado, I. & Huster, D. Dynamics of Amyloid-β Fibrils Revealed by Solid-state NMR. J Biol Chem 287, 2017–2021 (2012).
Die unverzweigten und oft verdrehten Fibrillenstrukturen haben einen Durchmesser von 10-20 nm und sind bis zu wenige Mikrometer lang. Zwei dicht gepackte β-Faltblätter (alle gelben und grünen Pfeile in Abbildung 2), deren Stränge senkrecht zur Faserachse laufen, bilden die sogenannte cross-β Struktur mit einem charakteristischen Röntgenbeugungsmuster. Die intermolekularen Wechselwirkungen zwischen den Polymerketten unterscheiden sich von den intramolekularen innerhalb derselben Kette und dominieren die Bildung der Proteinaggregate. Dabei interagieren β-Stränge verschiedener Peptide innerhalb der Fibrille über H-Bindungen, die parallel zur Fibrillenachse sind. In Abbildung 2 sind die entsprechenden β-Stränge (gelbe und grüne Pfeile), hier am Beispiel von β-Amyloid(1-40) gezeigt, parallel zueinander in den beiden β-Faltblättern ausgerichtet.
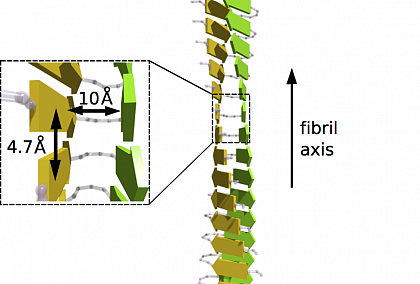
Abbildung 2: Schema der Cross-β Struktur einer reifen Amyloid-Fibrille mit
dicht gepackter zweischichtiger β-Faltblattstruktur. Jedes β-Faltblatt ist durch
die gelbe oder grüne Farbe gekennzeichnet und weißt eine parallele Ausrichtung
der β-Stränge (gelbe und grüne Pfeile) auf.
Diese reifen Fibrillen sind das Endprodukt eines Prozesses, der bisher nicht vollständig verstanden ist. Die toxischen Zwischenprodukte (Oligomere und Protofibrillen) der Amyloid-Fibrillen werden mit tödlichen Krankheiten in Verbindung gebracht. Diese Amyloid-Erkrankungen (z.B. Alzheimer) beinhaltet überwiegend die Aggregation von Proteinen. Dies kann zu extrazellulären Ablagerungen von Amyloid-Plaques in dem betroffenen Gewebe, wie dem Gehirn führen. Die Ablagerungen befinden sich im Bereich von kaum nachweisbaren Mengen bis hin zu buchstäblich Kilogramm an Proteinen.
Über die Frage "Was passiert mit der Struktur während der Bildung von Amyloid-Fibrillen und welche strukturellen Veränderungen treten dabei auf?" wird nach wie vor diskutiert. Forscher aus der Gruppe von Daniel Huster (Uni Leipzig) sind dieser Frage im SFB-Projekt A06 nachgegangen.





